紅藻 Cyanidium caldarium のPSI-LHCI超複合体の立体構造とLHCの分子進化の解明
【研究のポイント】
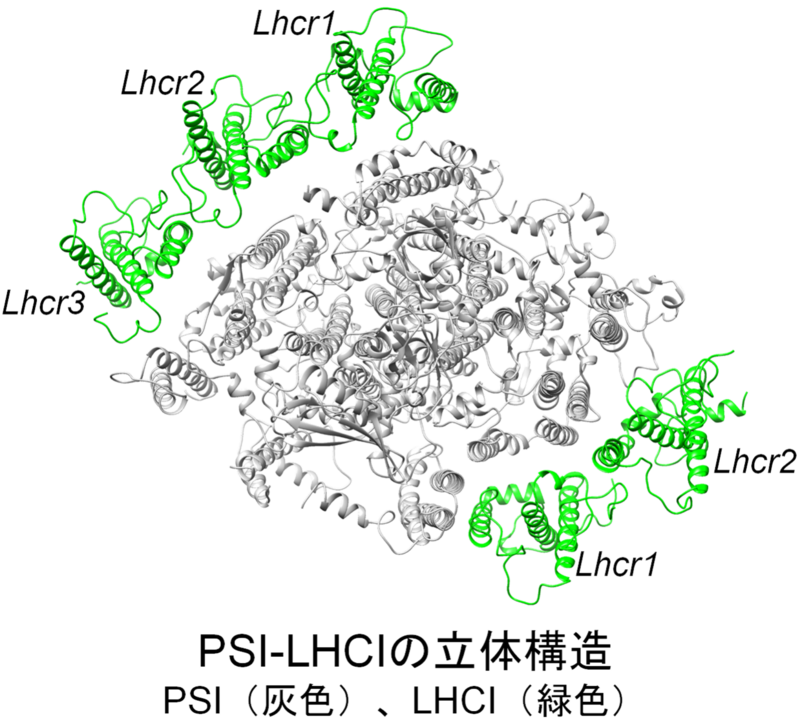
● クライオ電子顕微鏡(注1)を用いた単粒子構造解析(注2)により、酸素発生型光合成(注3)を行う紅藻(注4)Cyanidium caldarium(以下、C. caldarium)の光化学系I(PSI)(注5)と集光性色素タンパク質(LHC)(注6)から構成されるPSI-LHCI超複合体の立体構造を解明しました。
● C. caldarium PSI-LHCIはPSI単量体に5個のLHCIサブユニットが結合した分子構造であることを明らかにしました。
● PSI-LHCIの構造解析に基づいたLHCIタンパク質の分子系統解析により、紅藻を起点とする紅色進化系統(注7)におけるLHCIの進化モデルを提案しました。
【研究概要】
静岡大学の 長尾 遼 准教授、岡山大学の 加藤 公児 特任准教授、沈 建仁 教授、理化学研究所・東北大学の 米倉 功治 グループディレクター・教授、濵口 祐 准教授、京都大学の熊沢 穣 博士課程生、伊福 健太郎 教授の研究グループは、理化学研究所の堂前直ユニットリーダー、豊橋技術科学大学の 広瀬 侑 准教授らと共に、クライオ電子顕微鏡(日本電子社 CRYO ARM 300)を用いた単粒子構造解析により、紅藻C. caldarium由来のPSI-LHCIの立体構造を1.92 Åの分解能(注8)で解明しました。
得られたPSI-LHCI構造には、PSI単量体に5個のLHCIが結合していました。
また、C. caldariumを含むPSI-LHCIの立体構造が明らかとなっている紅色進化系統のLHCIに焦点を絞り、分子系統解析に基づくLHCIの進化モデルを提案しました。
LHCの進化に関する研究は分子系統解析が主流ですが、この方法だけではどのLHCがPSIに結合するのかを特定することができません。
本研究では、PSIに結合するLHCIを立体構造解析によって特定し、その特定されたLHCIのみに焦点を当てた分子系統解析を行いました。
このアプローチにより、紅色進化系統のLHCIの分子進化について、これまでにない角度からの理解が可能になりました。
このように、立体構造解析と分子系統解析を組み合わせることにより、LHCIの進化に関する研究に新たな潮流が生まれることが期待されます。
本研究成果は、2024年3月5日に、Proceedings of the National Academy of Sciences of the United States of Americaに掲載されました。
【研究者コメント】
静岡大学農学部 准教授・長尾 遼(ながおりょう)
本研究では、それぞれのグループの専門的な知識や技術を融合することにより、LHCの進化に迫る新たな研究の方向性を示すことができました。
今後も本研究基盤を利用することにより、LHCの進化を探求していきたいです。
【論文情報】
掲載誌名:Proceedings of the National Academy of Sciences of the United States of America
論文タイトル:The structure of PSI-LHCI from Cyanidium caldarium provides evolutionary insights into conservation and diversity of red-lineage LHCs
著者:Koji Kato, Tasuku Hamaguchi, Minoru Kumazawa, Yoshiki Nakajima, Kentaro Ifuku, Shunsuke Hirooka, Yuu Hirose, Shin-ya Miyagishima, Takehiro Suzuki, Keisuke Kawakami, Naoshi Dohmae, Koji Yonekura, Jian-Ren Shen, Ryo Nagao
DOI:https://www.pnas.org/doi/10.1073/pnas.2319658121
【用語説明】
注1:クライオ電子顕微鏡
タンパク質などの生体分子を水溶液中の生理的な環境に近い状態で、電子顕微鏡で観察するために開発された手法です。
まず、試料を含む溶液を液体エタン(約-180℃)に落下させて急速凍結し、アモルファス(非晶質、ガラス状)な薄い氷に包埋します。
これを液体窒素(-196℃)条件下で、透過型電子顕微鏡で観察します。
電子顕微鏡内の真空中では試料は凍結状態を保持でき、また、冷却することにより電子線の照射による損傷を減らすことができます。
注2:単粒子構造解析
電子顕微鏡で撮影した多数の生体分子の像から、その立体構造を決定する構造解析手法のことをいいます。
2017年のノーベル化学賞の受賞者の一人、Joachim Frankらにより単粒子解析法の基礎がつくられました。
注3:酸素発生型光合成
光合成には酸素発生型光合成と酸素非発生型光合成があります。
酸素発生型光合成は、光化学系I、シトクロムb6f、光化学系II、ATP合成酵素と呼ばれるそれぞれの膜タンパク質複合体によって駆動され、光エネルギーを利用して水と二酸化炭素から炭水化物と酸素を合成します。
酸素非発生型光合成生物が進化して酸素発生型光合成生物になったと考えられています。
注4:紅藻
紅藻(こうそう)とは、世界に約4,000種類いるといわれる真核藻類群です。
紅藻の多くは「赤っぽい色」を呈しますが、本研究で使用したC. caldariumは緑色です。
紅藻の種類は、微生物から大きな葉状構造を持つ種まで幅広く存在します。
注5:光化学系I(PSI)
光エネルギーを化学エネルギーへ変換する膜タンパク質複合体です。
PSIは10種類以上のサブユニットから構成され、補欠因子として、金属錯体、色素分子(クロロフィルやカロテノイド)がタンパク質に結合しています。
クロロフィルとカロテノイドはそれぞれ特有の光エネルギー吸収帯を持ち、光捕集に重要な役割を担います。
注6:集光性色素タンパク質(LHC)
太陽光エネルギーを捕集し、光化学系Iや光化学系IIに伝達するための色素タンパク質です。
パラボラアンテナのように光エネルギーを集めるため、アンテナタンパク質とも言われます。
集光性色素タンパク質は光合成生物種間で多様であるため、結果として、光合成生物に見た目の色の違いを生じさせています。
注7:紅色進化系統
紅藻から進化した藻類群のことで、紅藻、珪藻、褐藻、ハプト藻、渦鞭毛藻などを含みます。
注8:分解能
どのくらい細かくものを「見る」ことができるかの指標です。
数値が小さい程、分解能が高いと言え、物質をより精細に観測できます。
原子と原子の距離は、1.2-1.5オングストローム(Å、1 Åは100億分の1メートル)程度であるので、個々の原子を区別するには1.5 Å程度の空間分解能が必要となります。
問い合わせ先:
【研究に関すること】
静岡大学農学部
准教授・長尾 遼(ながお りょう)
TEL:054-238-4251
E-mail:nagao.ryo[at]shizuoka.ac.jp
WEBサイトやSNSのまとめ:https://linktr.ee/ryonag
理化学研究所 放射光科学研究センター
グループディレクター・米倉 功治(よねくら こうじ)
(東北大学 多元物質科学研究所 教授)
E-mail:yone[at]spring8.or.jp
岡山大学 異分野基礎科学研究所
教授・沈 建仁(しん けんじん)
E-mail:shen[at]cc.okayama-u.ac.jp
【報道に関すること】
静岡大学 広報・基金課
TEL:054-238-5179
E-mail:koho_all[at]adb.shizuoka.ac.jp
岡山大学 総務・企画部 広報課
TEL:086-251-7292
E-mail:www-adm[at]adm.okayama-u.ac.jp
理化学研究所 広報室 報道担当
TEL:050-3495-0247
E-mail:ex-press[at]ml.riken.jp
東北大学 多元物質科学研究所 広報情報室
TEL:022-217-5198
Email:press.tagen[at]grp.tohoku.ac.jp
京都大学 渉外部広報課国際広報室
TEL:075-753-5729
E-mail:comms[at]mail2.adm.kyoto-u.ac.jp
豊橋技術科学大学 総務課広報係
TEL:0532-44-6506
E-mail:kouho[at]office.tut.ac.jp
※全て[at]を@に変更してください